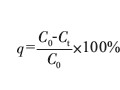硼酸在電鍍工業(yè)中有著廣泛的應(yīng)用,然而,對于硼酸的結(jié)構(gòu)、酸性問題的認識比較模糊,乃至各種大 學(xué)教科書中對珊酸在水溶液中的酸式電離及其強化 問題的敘述存在混亂。文獻[lJ指出,硼酸為一元弱 酸 .Ka=7. 3 X 10-10 • 但文獻[2J 則認為硼酸為三元 酸 .K1 = 5.8 X 10-10 • K2 = 1.8 X 10-13 • K3 = 3. 0 X10-14 0 文獻[3J認為硼酸有三級電離,且電離常數(shù)與 文獻的不同.K1 =7. 3X10-10 • K2=1.8 X 10-13 • K3=1.6X10-14 。文獻雖然把硼酸作為一元酸 處理,但電離常數(shù)則用幾表示,這意味著還有幾 和凡,即:硼酸可能是多元酸。由此可見,存在著硼 酸在水溶液中究竟是一元酸還是多元酸的問題,同 時,不同文獻的電離常數(shù)各不相同,有點混亂。
在電鍍行業(yè)內(nèi),存在著同樣的困惑。電鍍行業(yè) 期刊白,12] ,專著[6-8J 認為硼酸能夠電離出 H+ 而顯示 酸性。有的人認為是三元酸,可能只是根據(jù)分子式 判斷的。因此,搞清楚硼酸的電離方式、酸性來源、電離 常數(shù)數(shù)據(jù)等問題,對電鍍行業(yè)和化學(xué)界都是很有意 義的。
1 硼酸的酸性問題
1.1 硼酸的分子結(jié)構(gòu)
硼酸的分子式習(xí)慣寫成凡B03 • 僅從表面上看有 3 個 H+ ,是三元酸,應(yīng)該有三級電離平衡常數(shù)。 實際上,硼酸的分子式應(yīng)該是 B(OH)3 .是一元酸。
硼原子的電子層結(jié)構(gòu)為 lS2 2S2 2氏。當(dāng)硼與 OH一結(jié)合時,硼原子的 1 個 2S 電子激發(fā)到 1 個空 的 2P 軌道中,使得硼原子的電子層結(jié)構(gòu)變?yōu)?lS22S1 2P 2P;。硼原子的 2S 軌道和 2 個 2P 軌道 雜化組合成 3 個 Sp2 雜化軌道.3 個 Sp2 雜化軌道 分別與 3 個 OH一 中的氧原子的各 1 個 2P 軌道重疊 形成 3 個 SP-P 的 σ 鍵。由于 3 個 Sp2 雜化軌道在同一個平面上,且夾 角為 1200 •所以硼酸分子具有平面三角形結(jié)構(gòu)。
1.2硼酸的酸性來源
硼酸在水溶液中之所以顯示出極弱酸性,是由于 OH一 中氧的孤電子對填入了硼原子的 P 空軌道 中,而不是本身電離給出質(zhì)子的緣故。
B(OH)3 + H20 [B(OH)4J- + H+ (1)
這種加合方式表現(xiàn)了珊化合物的缺電子特點。 根據(jù) 1923 年路易斯提出的酸堿電子理論:凡是可以 接受電子對的物質(zhì)稱為酸,凡是可以給出電子對的 物質(zhì)稱為堿,因此,珊酸是一個典型的路易斯酸。
1.3 硼酸的電離。
硼酸是一元酸,為什么有些大學(xué)教科書及手冊 提到硼酸為三元酸,還有三級電離常數(shù)? 1930 年 Hahn F L等的論文介紹,測得硼酸的 pK1 為9.24. pK2 為 12.74. pK3 為 13. 40 0 lngri N 等在上世紀60 年代對這一問題做了深入研究,以氫電極為指示 電極,用電位法研究了硼酸的平衡,未證實水溶液中有 HBO/-或 B03 3- 等高價陰離子存在。他們又用Pb-Hg 齊電極測定溶液中 OH- 的濃度,用強堿滴 定 H2B03 一 ,同樣證明 OH一 的濃度達到 0.5 mol/L 時,水溶液中沒有 HB032- 或 B03 3- 存在。他們的 精確試驗結(jié)果與前面兩篇提到的凡B03 有三級電 離平衡的結(jié)論是矛盾的。假如硼酸的 pK1 為 9.24. pK2 為 12. 74.pK3 為 13.40.則當(dāng)溶液中的 OH- 的 濃度達到 O. 5 mol/L (pH 值達到 13. 7)時,宋立妹, 周曉鴻陽通過計算求得溶液中 的 ó'H2 B03 - =0.013 .ó'HBO/ - = 0.331.ó'B03 3 - = 0.656.即:溶液 中應(yīng)有大量 B033- 及 HB03 2- 存在,而這與試驗結(jié) 果完全不符。用試驗方法未能證明硼酸有二級和三級電離平 衡,只能認為硼酸是一元酸。有些大學(xué)教科書及手 冊中用 K1 表示硼酸的電離常數(shù),這也是不妥當(dāng)?shù)摹?它使人產(chǎn)生硼酸在水溶液中有三級電離的錯誤概 念。建議用 Ka 表示。
1.4 硼酸酸性的強化
硼酸是缺電子化合物,是一個路易斯酸。它與油或甘露醇或其他多元醇反應(yīng)時,能生成穩(wěn)定的配位物,從而使硼酸溶液的酸性增強。 其反應(yīng)有兩種,第一種是:
所生成的甘油硼酸配位物 Ka=7.08 X 10-6 ,第二種則認為反應(yīng)機理應(yīng)表述為:

這兩種解釋方法的相同點是:硼酸與多元醇通過醋化反應(yīng)生成穩(wěn)定的配位物,使得溶液酸性增強,但是它們的反應(yīng)機理卻不盡相同,到底哪一種反應(yīng)機理比較合適呢?仔細分析看來,這兩種機理均有失妥當(dāng)。
陳經(jīng)濤認為在硼酸的水溶液中加入甘油或 甘露醇或其他多元醇時,B(OH)4 - 和這些多元醇 發(fā)生醋化反應(yīng),脫去 4 分子的水,生成一個包含有兩個六圓環(huán)的穩(wěn)定的配位物,其反應(yīng)可以表示如下:

從結(jié)構(gòu)式的角度把甘油看作是水的皖基衍生物。由于燒基的給電子效應(yīng),甘油中氧原子上電子密度比水中的高。所以筆者認為,硼酸與甘油之間發(fā)生了配位〈加合)反應(yīng),而不是醋化反應(yīng)。這與確酸和水的加合相同,而且甘油比水更容易與硼酸形 在 B(OH)3 中,硼是以 3 個 Sp2 雜化軌道與氧 密度比水中的高。所以筆者認為,硼酸與甘油之間 形成 3 個共價鍵,僅余 1個空 P 軌道,只能與 1 個氧 加合,不會與 2 個或 3 個氧加合。因此,硼酸只能接 受甘油分子的一個是基,反應(yīng)物比例是 1: 10
1.5 甜酸的緩沖作用

緩沖劑在電鍍工業(yè)中的應(yīng)用很廣泛,緩沖溶液只有在 pH=pKa 時,才具有最大的緩沖能力。另 外,還與緩沖劑的濃度有關(guān),當(dāng)共輒酸堿對的濃度比 為 1 : 1時,總濃度越大,緩沖能力也越大。一般應(yīng) 用中所取的緩沖范圍都在(pKa::l: 1)之內(nèi)。珊酸的 Ka 是 7.3 X 10-1O ,pKa=9.14 ,所以硼酸的最佳緩 沖范圍是 8. 14 10.14。電鍍工業(yè)使用硼酸作緩沖 劑時,濃度取 O. 51.0 mol/L,濃度太高,受溶解度 的限制不能溶解完全。
2 使用硼酸時注意事項
2.1 硼酸的溶解度 純水中硼酸的溶解度為:OOC3g,10 0C3g,20 0C 5 g,30 oC 7 g,40 "c 9 g,50 oC 11 g,60 oC 15 g,70 0C 18 g,80 oC 23 g,90 oC 29 g,100 oC 37 g。在電鍍?nèi)芤褐校嬖诟鞣N無機鹽和有機物,會使 硼酸的溶解度低于純水中的溶解度。

2.2 硼酸在溶渡中是否存在四硼酸 硼酸實際上是氧化棚的水合物 B203 • 3比0,其比重為1.435(15 OC)。珊酸在水中的溶解度隨溫度升高而增大,并能隨水蒸汽揮發(fā),在無機酸中的溶 解度要比在水中的小。加熱至 70 100 oC 時,逐漸 脫水生成偏珊酸,150160 oC 時生成焦棚酸,300 0C 時生成硼酸哥(B2 03λ四珊酸分子式為 H2 B4 07 ,又稱焦棚酸。溶于 水、乙醇,由棚酸加熱至 160 oC 脫水而制得。
文獻[8 ,13J認為,隨著硼酸濃度的提高,有一部 分硼酸會轉(zhuǎn)化成四棚酸,硼酸的濃度越高,越有利于其轉(zhuǎn)化成四硼酸,而四硼酸的緩沖作用更好。
4H3 B03 = H2B407 + 5H20
(6)這個觀點需要探討,硼酸固體加熱至 160 oC 以上,才能脫水為四棚酸。電鍍?nèi)芤阂话阍?60 0C 左右工作,達不到生成西硼酸的條件,最多形成硼酸的飽 和溶液。
緩沖容量與緩沖榕液的總濃度及各組分的濃度 比有關(guān)。總濃度越大,緩沖容量越大;總濃度一定 時,各緩沖組分的濃度憂越接近 1 : 1,緩沖容量越 大;當(dāng) pH=pKa 時,緩沖容量最大。可見,無法比 較硼酸與四硼酸的緩沖能力,只能比較兩者的緩沖 范圍。然而,四硼酸的電離平衡常數(shù)無從查證,故四 棚酸的緩沖范圍也不能知曉。