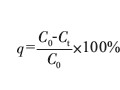【簡介】
(南京工業(yè)大學材料科學與工程學院,江蘇南京210009)
[摘要]采用NaBH4作為還原劑回收電鍍廢液中的銅。正交實驗結果表明,各因素對剩余銅離子質量濃度的影響的顯著性順序為n(NaBH4)∶n(CuSO4)>反應時間>反應溫度。最佳實驗條件為:n(NaBH4)∶n(CuSO4)=1.50,反應溫度
[關鍵詞]電鍍廢液;銅;化學還原法;硼氫化鈉;回收;納米銅粉;綜合利用
[中圖分類號]X703;TB44 [文獻標識碼]A [文章編號]1006-1878(2010)04-0327-05
由于存在鍍液老化等問題,電鍍行業(yè)排放的電鍍銅廢液中銅離子質量濃度在幾克/升至幾
本工作以NaBH4作為還原劑,采用化學還原法處理酸性電鍍銅廢液,得到納米銅粉。研究了各工藝參數對剩余銅離子質量濃度的影響,并對所制得的銅粉的粒度、物相及抗氧化性能進行了表征,為實現其高附加值利用奠定了基礎。
1實驗部分
1.1原料、試劑和儀器
實驗采用酸性硫酸鹽電鍍銅后的廢液,銅離子質量濃度為
Dmax/RB型X射線衍射(XRD)儀:日本理學公司;UV-2102PC型紫外-可見分光光度計:上海尤尼柯儀器有限公司;TDL-5-A型臺式離心機:上海安亭科學儀器廠;DZF-6020型真空干燥箱:上海博訊實業(yè)有限公司;HH-2型數顯恒溫水浴鍋:常州國華電器有限公司;JJ-1型精密增力電動攪拌器:常州國華電器有限公司;BS432S型電子天平:北京賽多利斯儀器系統有限公司;TECNAI型掃描電子顯微鏡(SEM):美國FEI公司。
1.2實驗原理
NaBH4作為一種強還原劑,可與電鍍銅廢液中的CuSO4反應,制得純凈的銅粉,控制合適的工藝參數可使銅粉的粒徑達到納米級。NaBH4與CuSO4的反應方程式見式(1)。
4CuSO4+NaBH4+8NaOH=4Cu+4Na2SO4+NaBO2+6H2O (1)
1.3實驗方法
取40mL電鍍銅廢液加入氨水混合均勻,控制溶液pH為12,加入適量表面活性劑后得到溶液A;向NaOH溶液中加入NaBH4,配制成n(NaBH4)∶n(NaOH)=1∶8的溶液B。將盛有溶液B的燒杯置于恒溫水浴中,向溶液B中逐漸加入溶液A,同時強力攪拌,反應一定時間后將產物離心分離,用去離子水將分離產物洗滌3~4次,然后在一定濃度的苯駢三氮唑溶液中處理20min,再將產物在真空干燥箱中
1.4分析表征
采用GB7474—87《二乙基二硫代氨基甲酸鈉分光光度法》測定銅離子質量濃度;采用XRD儀測定銅粉的結構及物相組成;采用SEM對銅粉進行形貌觀察;使用美國Compix公司的SimplePCI軟件對銅粉的平均粒徑進行計算。
2結果與討論
2.1 n(NaBH4)∶n(CuSO4)對電鍍廢液中剩余銅離子質量濃度的影響
n(NaBH4)∶n(CuSO4)對電鍍廢液中剩余銅離子質量濃度的影響見圖1。由圖1可見:隨n(NaBH4)∶n(CuSO4)增大,電鍍廢液中剩余銅離子質量濃度下降;當n(NaBH4)∶n(CuSO4)=1.50時,電鍍廢液中剩余銅離子質量濃度最低,為4.2mg/L。由式(1)可知,NaBH4與CuSO4完全反應時的物質的量比是0.25,但實驗中發(fā)現當n(NaBH4)∶n(CuSO4)=1.00時,反應才趨于完全。根據文獻可知,CuSO4和NaBH4的反應分為3步進行,在第二步的過程中部分NaBH4發(fā)生了副反應,導致加入的BH-4不能全部參與銅的氧化還原反應。因此必須加入過量的NaBH4才能將廢液中的銅全部還原出來。

2.2反應時間對電鍍廢液中剩余銅離子質量濃度的影響
反應時間對電鍍廢液中剩余銅離子質量濃度的影響見圖2。

由圖2可見:隨反應時間延長,電鍍廢液中剩余銅離子質量濃度下降;反應30min時,電鍍廢液中剩余銅離子質量濃度最低,為3.5mg/L;反應時間超過40min時,電鍍廢液中的銅離子質量濃度升高,最后溶液呈藍色透明。這是因為,新生成的銅粉重新變?yōu)殂~離子進入溶液中。因此,反應時間選擇20~40min為宜。
2.3反應溫度對電鍍廢液中剩余銅離子質量濃度的影響
反應溫度對電鍍廢液中剩余銅離子質量濃度的影響見圖3。由圖3可見:隨反應溫度升高,電鍍廢液中剩余銅離子質量濃度先減小;當反應溫度為

2.4正交實驗結果
根據上述單因素實驗結果,選定正交實驗因素水平,正交實驗因素水平見表1,正交實驗結果見表2。


由表2可見:各因素對電鍍廢液中剩余銅離子質量濃度的影響的顯著性順序為n(NaBH4)∶n(CuSO4)>反應時間>反應溫度。最佳實驗條件為:n(NaBH4)∶n(CuSO4)=1.50,反應溫度
2.5所制得銅粉的表征
按照最佳實驗條件所制得銅粉的XRD譜圖見圖4,所制得銅粉的SEM照片見圖5。由圖4可見,所制得銅粉的特征峰與標準卡片4-836一致,存在的雜峰為銅的氧化物,說明制得的銅粉發(fā)生了一定的氧化。由圖5可見,銅粉呈類球形且顆粒細小、均勻,粒徑分布較窄。


2.6表面活性劑對銅粉粒徑的影響
表面活性劑對銅粉粒徑的影響見表3。由表3可見,加入表面活性劑后銅粉的粒徑均有一定程度的減小,說明在銅粉制備過程中加入表面活性劑可以起到控制銅粉粒徑的作用。原因可能是在晶粒生成的初期,表面活性劑親水一端吸附于顆粒新生成的表面,形成以疏水基朝水相的局部單分子層,使銅離子難以在表面上附著,顆粒難以繼續(xù)長大。很明顯,在控制顆粒長大的過程中,吐溫-80和明膠這兩種非離子型表面活性劑比離子型表面活性劑三乙醇胺和十二烷基苯磺酸鈉-6更加優(yōu)越,生成的銅粉顆粒粒徑更小。

2.7銅粉的抗氧化性能
由于納米銅粉比表面積大,化學性質活潑,常溫下在空氣中很容易被氧化,導致粉體純度降低。目前解決該問題的方法是對銅粉進行表面處理,主要有表面鍍銀、有機膦化物處理、偶聯劑改性、存放在惰性氣體或有機溶劑中等。本實驗采用苯駢三氮唑對回收銅粉進行抗氧化處理。
未經處理和經過抗氧化處理的銅粉的XRD譜圖見圖6。由圖6可見,未經抗氧化處理的銅粉的XRD譜圖上存在銅、氧化銅和氧化亞銅的峰,銅的特征峰分別對應立方晶系銅的(111),(200),(220)面。由銅特征峰的位置可知其晶胞參數為0.3621nm,與標準卡片4-836晶胞參數0.3615nm相比,晶胞略微發(fā)生膨脹。經苯駢三氮唑處理的銅粉的XRD譜圖中未見氧化銅的峰,而氧化亞銅峰的強度也顯著降低,說明經過苯駢三氮唑處理可有效防止銅粉氧化。這是因為,苯駢三氮唑可以吸附在銅粉表面,形成一層穩(wěn)定的絡合物膜,以隔絕銅粉與空氣的接觸,進而阻止其表面氧化。

3結論
a)以NaBH4作為還原劑,采用化學還原法處理酸性電鍍銅廢液,得到納米銅粉。
b)正交實驗結果表明,各因素對電鍍廢液中剩余銅離子質量濃度的影響的顯著性順序為n(NaBH4)∶n(CuSO4)>反應時間>反應溫度。最佳實驗條件為:n(NaBH4)∶n(CuSO4)=1.50,反應溫度
c)在銅粉制備過程中加入非離子型表面活性劑可有效阻止晶粒長大,并提高其分散性能,使產物粒徑均勻。
d)采用苯駢三氮唑處理后的銅粉抗氧化能力明顯提高。
參考文獻
1·宋玉亮,廖輝偉.酸性蝕刻廢液制備納米銅粉及其穩(wěn)定性研究.功能材料,2007,38(6):986~988
2·張秋利,楊志懋,丁秉鈞.硼氫化鉀還原法制備納米銅粉.中國有色金屬學報,2008,18(1):348~352
3·Chang ShihHsien,WangKai Sung,Hu Pe.iRapid recovery of dilute copper from asimulated Cu-SDS solution withlow-cost steel wool cathode reactor.J Hazard Mater,2008,(7):544~549
4·王菊香,趙恂,潘進等.超聲電解法制備超細金屬粉的研究.材料科學與工程,2000,18(4):70~74
5·Chm ielewski A G,Urbanski T S,M igdaW.Separationtechnologies for metals recovery from industrial wastes.Hydrometallurgy,2007,45(3):333~344
6·徐德志,相波,邵建穎等.膜技術在工業(yè)廢水處理中的應用研究進展.工業(yè)水處理,2006,26(4):1~4
7·Nuhoglu Y,Malkoc E.The removal of Cu(Ⅱ)from aqueoussolutions by Ulothrix zonata.Bioresour Techno,l2002,85(3):331~333
8·張子間,劉玉榮,劉家弟.鐵炭微電解-生化法處理電鍍廢水.化工環(huán)保,2007,27(4):338~341
9·林榮會,方亮,郗英欣等.化學還原法制備納米銅.化學學報,2004,63(23):2365~2368
10·閆雷,于秀娟,李淑琴等.硼氫化鈉還原法處理化學鍍鎳廢液.化工環(huán)保,2002,22(4):213~216
11·徐銳,周康根,胡敏藝.水合肼液相還原法制備銀包覆超細銅粉反應機理研究.稀有金屬材料與工程,2008,37(5):905~908
12·劉志杰,趙斌,張宗濤等.超細銅粉表面磷化及其抗氧化性能研究.無機化學學報,1996,12(2):193~196
13·徐溢,滕毅,徐銘熙.硅烷偶聯劑應用現狀及金屬表面處理新應用.表面技術,2001,30(3):48~51
14·何益艷,范修濤,陸瑞卿等.銅粉表面包覆硅烷偶聯劑改性研究.腐蝕與防護,2006,27(2):69~71